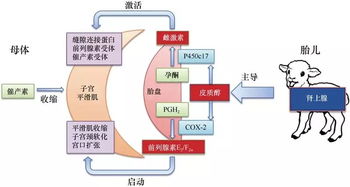
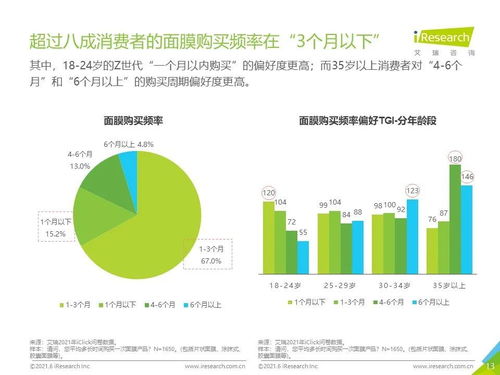
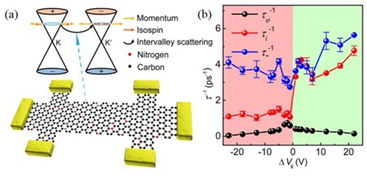
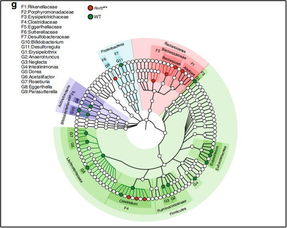
腸道微生物如何影響抗癌效果?《自然》子刊聯合四十余位科學家揭示關鍵機制
一項發表于國際頂級學術期刊《自然》子刊的重磅研究,為癌癥治療領域帶來了突破性見解。來自全球多個頂尖研究機構的四十余位科學家共同發布的研究成果,首次系統性地揭示了腸道微生物群影響癌癥免疫治療效果背后的深層生物學原因。這項研究不僅深化了我們對“腸-癌軸”的理解,也為未來開發基于微生物組的個性化抗癌療法提供了堅實的科學基礎。
長期以來,臨床觀察發現,不同癌癥患者對同一種免疫檢查點抑制劑等抗癌藥物的反應存在巨大差異。越來越多的證據將這種差異指向了一個意想不到的“器官”——腸道及其內部數以萬億計的微生物。微生物究竟通過何種具體機制來“遙控”遠端的腫瘤微環境,始終是懸而未決的核心謎題。
此次聯合研究團隊通過整合多組學分析、動物模型實驗以及臨床患者數據,成功“實錘”了其中的關鍵通路。研究發現,特定的腸道菌群及其代謝產物,能夠通過血液循環系統,直接或間接地調節人體全身性的免疫狀態。具體而言,某些有益菌株可以代謝膳食纖維,產生短鏈脂肪酸(如丁酸)等小分子物質。這些物質不僅能增強腸道屏障功能,減少全身炎癥,還能作為信號分子,促進骨髓中具有抗腫瘤活性的免疫細胞(如特定的T細胞亞群)的分化與增殖。
反之,當腸道菌群失調,有害菌占據優勢時,則可能產生促炎代謝物,抑制免疫系統的抗癌功能,甚至直接削弱藥物療效。研究團隊精準鑒定出了幾類與積極治療反應呈正相關或負相關的細菌類群及其特征代謝物圖譜,為預測患者療效提供了潛在的生物標志物。
該研究隸屬于“自然科學研究和試驗發展”范疇,其成果是基礎科學向臨床醫學轉化的典范。它從分子和細胞層面,將復雜的微生物生態系統與宿主的系統性免疫應答連接起來,闡明了微生物影響抗癌效果的因果鏈條。這一發現具有重大的應用前景:醫生或許可以通過分析患者的腸道菌群構成,提前預測其對免疫療法的敏感性;更進一步,通過飲食干預、益生菌/益生元補充、甚至糞便微生物移植(FMT)等手段,有目的地塑造“有益”的腸道微生態,從而增強現有抗癌療法的效果,或幫助那些原本對治療無反應的患者重獲希望。
這項由大規模國際合作完成的研究,標志著我們在利用人體內共生微生物對抗癌癥的道路上邁出了關鍵一步。它證實了腸道不僅是消化器官,更是人體健康的“戰略指揮部”之一。隨著研究的深入,以微生物組為靶點的“協同抗癌”策略,有望成為腫瘤精準治療新時代的重要支柱。
如若轉載,請注明出處:http://www.fcke.cn/product/52.html
更新時間:2026-02-10 06:54:36